г. Москва и Московская область, Россия
УДК 612.616 Яичко (testis) и его оболочки. Сперма. Семенная жидкость
Представлен анализ собственных и литературных данных о последствиях воздействия различных стрессорных стимулов на развитие и функционирование нейроэндокринной и репродуктивной систем у животных и человека. Особое внимание уделено влиянию инфекционных факторов матери, вызывающих воспаление, на развивающийся организм плода. Воспалительные процессы могут изменять физиологические концентрации регуляторных молекул и нарушать механизмы развития. Основной мишенью для негативного воздействия продуктов воспаления в критические периоды онтогенеза является мозг. В дальнейшем это приводит к увеличению риска возникновения у потомства различных психоневрологических заболеваний, таких как аутизм, болезнь Альцгеймера, болезнь Паркинсона, шизофрения, депрессия. Вызванные воспалением нарушения развития репродуктивной оси могут приводить к подавлению репродуктивной способности и развитию бесплодия. Эпигенетические механизмы развития характеризуются высокой чувствительностью к различным регуляторным факторам, что открывает возможности коррекции нарушений. В последние годы предпринимаются попытки предотвратить последствия воспаления у плода. Подходы, направленные на выявление и коррекцию перинатальных нарушений, открывают возможность сохранения здоровья у половозрелого потомства.
пренатальный стресс, системное воспаление, нарушения развития, нейроэндокринная система, репродуктивная ось, провоспалительные цитокины, пренатальная коррекция
ВВЕДЕНИЕ
Регуляция становления различных функций в развивающемся организме осуществляется единой сложной суперсистемой, включающей нейроэндокринную и иммунную системы. Воздействия стрессорных факторов, таких как неправильный образ жизни и питание матери во время беременности и кормления ребенка, прием лекарств и наркотиков, травмы, бактериальное или вирусное инфицирование могут изменять формирование, а в дальнейшем и функционирование этих систем (рис. 1).

Рис. 1. Адаптационная пластичность физиологических систем в норме и при патологических состояниях.
Благодаря их пластичности, развивающийся организм адаптируется к измененным условиям и выживает. Однако неблагоприятные воздействия нарушают эпигенетические механизмы регуляции специфических генов, что приводит к изменению у плода фенотипа [1]. Фенотипические изменения вызывают стабильные и долговременные изменения генной транскрипции. В результате изменяются процессы, контролирующие структуру и функции физиологических систем, что может служить основой возникновения у потомства различных патологических состояний [2-4].
Существенным фактором риска для развивающегося организма являются вирусная или бактериальная инфекции матери, вызывающие воспаление. Развитие воспалительных процессов сопровождается усилением синтеза эйкозаноидов, адгезивных молекул, про- и противовоспалительных цитокинов, образованием оксидантов, индуцирующих патофизиологическую реакцию организма плода. Бактериальные инфекции, особенно бессимптомно протекающие во время беременности, могут привести к серьезным осложнениям, включая нарушения органогенеза и преждевременные роды [5, 6].
Наиболее чувствительным к продуктам воспаления является мозг, нарушения развития которого увеличивают риск возникновения у потомства
шизофрении, аутизма, нейродегениративных заболеваний, таких как болезнь Паркинсона и Альцгеймера [3, 7, 8]. Драматические изменения, происходящие в мозге плода под действием стресса, приводят к нарушениям развития не только нервной, но и эндокринной, в том числе гипоталамо-гипофизарно-гонадной, систем. В дальнейшем, у половозрелого потомства, как мужчин, так и женщин, наблюдают нарушения функций гонад [2, 9]. В связи с этим, проводимая в половозрелом возрасте терапия зачастую не позволяет устранить выявленные нарушения.
Процессы становления физиологических систем характеризуются функциональной лабильностью и чувствительностью ко многим регуляторным факторам. Это открывает возможности для коррекции нарушений, вызванных стрессогенными стимулами, уже в раннем онтогенезе. К настоящему времени накапливаются данные о создании принципиально новых противовоспалительных биологических препаратов [10]. Для своевременного предупреждения нарушений у плода и сохранения здоровья у человека необходимо выявлять конкретные сигнальные молекулы и механизмы их действия в экспериментальных моделях.
В обзорной статье представлен анализ собственных и литературных данных о негативном влиянии различных стрессорных факторов, возможных механизмах их действия на развитие и функционирование нейроэндокринной системы и репродуктивной оси, а также о подходах к коррекции нарушений в этих системах у потомства в раннем онтогенезе.
ПЕРИНАТАЛЬНЫЙ СТРЕСС В ПАТОГЕНЕЗЕ ЗАБОЛЕВАНИЙ ПСИХОНЕВРОЛОГИЧЕСКОГО ХАРАКТЕРА
Сильным стимулом, изменяющим структуру и функции мозга плода, является перинатальный стресс. Воздействия на плод или новорожденного таких стрессорных факторов, как сильный звук, раннее отлучение от груди, жестокое обращение матери с ребенком, ноцицептивные (болевые) и травмирующие воздействия нарушают развитие мозга. При этом наблюдается уменьшение массы мозга, изменяется индукция ядерных транскрипционных факторов (c-fos, АР-1). Впоследствии у потомства развиваются агрессия, тревожность, депрессия и другие психоневрологические расстройства [3]. Хронический пренатальный стресс вызывает гипер - или гипоактивность мозга. Гиперфункция амигдалы приводит к развитию фобий (страха) у молодого потомства, а подавлениеактивности гиппокампа – к нарушению познавательной способности [11]. В зависимости от характера воздействия стрессорных факторов нарушения механизмов регуляции развития нейроэндокринной системы могут быть кратковременными или длительно текущими.
В ответ на перинатальный стресс, в первую очередь, активируется гипоталамо-гипофизарно-надпочечниковая система, где ведущая роль принадлежит глюкокортикоидам (кортизол у человека и кортикостерон у грызунов). Подавляя синтез или секрецию клетками гипоталамуса и гипофиза гормонов стресса, глюкокортикоиды ограничивают стресс-ответ. В то же время индуцированное стрессом повышение их содержания у плода может вызывать изменения функций гипоталамо-гипофизарно-надпочечниковой системы у взрослого потомства [11, 12]. При этом в гипофизе и коре надпочечников происходят патологические изменения. В гипофизе увеличивается синтез адренокортикотропного гормона, стимулирующего синтез надпочечниками кортикостероидов, что приводит к развитию у потомства гиперкортизолизма и специфического ожирения.
Существенное влияние на развитие мозга оказывает пищевое воздействие, известное, как метаболическое программирование [13]. Неправильное питание во время беременности или кормления ребенка может вызывать у него расстройства аутистического спектра (РАС), представляющие комплекс нарушений преимущественно в развитии нервной системы. Критическим периодом для развития аутизма считают первые 5–6 месяцев после рождения, а в 2–5-летнем возрасте у них выявляют генерализованное увеличение коры головного мозга с непропорциональным увеличением белого вещества височной доли [14]. Чрезмерное увеличение площади поверхности коры при аутизме может приводить к увеличению всего мозга и влиять на развитие патогенных механизмов, характерных для этого заболевания. Число детей с РАС увеличивается с каждым годом. Предполагается, что это связано с изменением пищевого рациона, приемом лекарственных средств и различных биологических добавок, а также с вирусными и бактериальными инфекциями в раннем развитии плода. Активный прием поливитаминов или витаминов группы В (Б) на последних сроках беременности может вызывать нарушения процессов инактивации моноаминов, в результате чего они накапливаются в организме плода, создавая фактор риска для развития РАС [15]. В крови аутичных детей выявляют повышенное содержание серотонина, дофамина и норадреналина,
с преимущественным содержанием серотонина. Вирусное или бактериальное инфицирование матери в период беременности увеличивает риск развития РАС в 2 раза. Согласно клиническим и экспериментальным данным, тяжесть РАС и нарушения поведенческих реакций после рождения могут быть связаны с различиями профиля цитокинов в раннем развитии [3].
Наряду с РАС, многие психоневрологические заболевания, возникающие после рождения ребенка, связывают с нейровоспалением в эмбриональный период развития [3, 7]. В наибольшей степени при нейровоспалении поражается белое вещество мозга плода, что часто приводит к развитию церебрального паралича у новорожденных. Ключевым маркером нейровоспаления является цитокин интерлейкин (ИЛ) 6 [16].
К настоящему времени появляется все больше доказательств, подтверждающих, что нейровоспаление вносит значимый вклад в патогенез болезни Паркинсона [17]. В экспериментальных моделях на грызунах показано, что локальное нейровоспаление, вызванное у матери эндотоксином липополисахаридом (ЛПС) грамотрицательных бактерий на ранних сроках беременности, приводит к гибели у потомства нейронов черной субстанции, синтезирующих дофамин. Снижение численности нейронов сопровождается повышенным содержанием в мозге плодов таких провоспалительных цитокинов, как ИЛ-6 и фактор некроза опухоли (ФНОα) [18]. Подобные патологические изменения в черной субстанции наблюдают у человека при развитии болезни Паркинсона. В половозрелом возрасте у потомства, особенно у самцов, снижается синтез дофамина и серотонина как в черной субстанции, так и в вентральной области мозга [19]. Подавление активности дофаминэргической системы приводит также к повышению риска развития некоторых форм зависимости, дистимии (подавленности), депрессии [3, 7].
Вирусная активация дофаминэргической системы на ранних сроках беременности может усиливать секрецию дофамина и развитие характерных признаков шизофрении у взрослого потомства. В мозге плодов выявляют повышенное содержание ФНОα. Свои эффекты при нейровоспалении цитокины могут реализовывать как непосредственным влиянием на структуры мозга через специфические рецепторы, так и опосредованно, путем секреции других медиаторов.
Увеличение численности людей с нейрональными расстройствами способствует росту интереса исследователей к поиску биомаркеров, позволяющих выявить лиц, подверженных риску возникновения этих заболеваний, и привести в дальнейшем к их целенаправленному лечению. По мере того, как появляется все больше доказательств, подтверждающих ключевую роль нейровоспаления в патогенезе психоневрологических заболеваний, обнаруживаются новые молекулярные мишени, которые потенциально могут предотвратить, или отсрочить их развитие. К настоящему времени не существует устойчивых биологических маркеров для их диагностики. Биологическая основа многих этих заболеваний до конца неясна. Существует мнение, что она включает в себя сложное взаимодействие между генетической восприимчивостью и воздействиями окружающей среды.
СИСТЕМНОЕ ВОСПАЛЕНИЕ В РАННЕМ РАЗВИТИИ НАРУШАЕТ РЕПРОДУКТИВНЫЕ ФУНКЦИИ У ПОЛОВОЗРЕЛОГО ПОТОМСТВА
Регуляция развития и функционирования гипоталамо-гипофизарно-гонадной системы, или оси млекопитающих осуществляется в тесном взаимодействии с иммунной системой в разные периоды онтогенеза [4]. Взаимодействия этих систем, начиная с эмбриогенеза, приводят к развитию половых признаков и становлению половозрелости. Репродуктивное здоровье потомства зависит от того, как закладываются и развиваются эти взаимодействия в раннем онтогенезе. Генетические, физиологические, социальные и экологические факторы способствуют развитию бесплодия, особенно при их воздействии в критические, т.е. наиболее чувствительные, периоды формирования репродуктивной оси. В экспериментах на грызунах нами было показано, что активация иммунной системы матери бактериальным эндотоксином ЛПС на ранних сроках беременности стимулирует продукцию провоспалительных цитокинов как у матери, так и плодов [20]. Увеличение содержания цитокинов выше физиологической нормы вызывает у потомства дисбаланс гормонов всей репродуктивной оси в разные периоды онтогенеза. В препубертатный период у самок увеличивается синтез мужского гормона тестостерона, а у самцов - женского гормона эстрадиола [2, 9]. В совокупности это приводит к нарушениям развития структуры и функций гонад, репродуктивного поведения и сниженной репродуктивной способности, как самцов, так и самок. В половозрелом возрасте у самцов подавлен синтез тестостерона, а у самок эстрадиола. При этом у самцов в семенных канальцах выявляют большое число симпластных сперматид на разных стадиях деградации и снижение числа клеток Сертоли, участвующих в сперматогенезе [21]. У самок наблюдается снижение числа фолликулов и увеличение их атрезии, когда фолликул прекращает свое развитие [9]. Кроме того, в гипоталамусе половозрелого потомства наблюдается подавление синтеза ключевого гормона репродуктивной оси - гонадотропин-рилизинг гормона, а в аденогипофизе - гонадотропинов, определяющих у них репродуктивные циклы [22].
Одной из причин мужского бесплодия являются также хронические инфекционные процессы, протекающие в половозрелом возрасте. Бактериальное или вирусное инфицирование урогенитального тракта индуцирует воспаление в семенниках и влияет на подвижность и количество сперматозоидов [23]. Низкое количество сперматозоидов обнаруживают у 15–20% молодых мужчин.
Таким образом, иммунологический стресс, индуцированный воспалением, оказывает негативное влияние на половое созревание и репродуктивную способность самцов и самок. Последствия этих влияний могут развиваться в течение всего постнатального периода. Рост семейных пар, страдающих бесплодием, становится серьезной проблемой для мужчин и женщин и составляет по всему миру около 15%. К настоящему времени накапливаются данные о возможности предотвратить или исправить кратковременные и долгосрочные последствия внутриутробного воспаления в критические периоды онтогенеза.
ПОДХОДЫ К КОРРЕКЦИИ НАРУШЕНИЙ РАЗВИТИЯ НЕЙРОЭНДОКРИННОЙ И РЕПРОДУКТИВНОЙ СИСТЕМ, ВЫЗВАННЫХ ВОСПАЛЕНИЕМ В РАННЕМ ОНТОГЕНЕЗЕ
При иммунологическом стрессе, вызванном воспалением, дефицит или избыток различных микроэлементов и витаминов в рационе матери, может усугублять его негативные последствия, приводящие к нарушениям развития мозга плода [15]. Эффективными нейропротекторами являются сульфат магния и цинка. Сульфат магния используют в терапии привычного невынашивания беременности, а также для снижения риска детского церебрального паралича. При локальном нейровоспалении магний и цинк подавляют образование свободных радикалов и синтез провоспалительных цитокинов в мозге плодов, предотвращая его повреждение [24]. Однако мнения по их использованию в качестве нейропротекторов при беременности противоречивы, поскольку данных подобного рода пока недостаточно.
Потенциальными нейропротекторами являются полиненасыщенные жирные кислоты (омега-3) и витамин D. Их дефицит в рационе беременных самок грызунов приводит к усилению воспалительных процессов [25, 26]. Дефицит витамина D в первом триместре беременности коррелирует с воспалительным процессом в плаценте и риском недонашивания, дефицита массы тела и неврологических нарушений у ребёнка [27]. Обогащение рациона грызунов витамином D снижает частоту развития дефектов нервной трубки, вызванных воспалением на ранних сроках беременности. Предполагается, что витамин D может подавлять развитие воспалительных процессов и включаться в регуляцию транспорта фолиевой кислоты, который нарушается при воспалении [28].
Антиоксидантными и противовоспалительными свойствами обладают также мелатонин, основная функция которого связана с регуляцией циркадных ритмов, аскорбиновая кислота (витамин С) и природные флавоноиды. После совместного введения индуктора воспаления ЛПС и аскорбиновой кислоты грызунам наблюдается снижение эмбриональной смертности, нарушений роста и развития потомства [29]. Флавоноиды такие, как лютеолин и его структурный аналог диосмин, содержащиеся в пищевых продуктах, обладают антибактериальным действием [30]. В качестве лекарственных средств применяются флавоноиды рутин и кверцетин, называемые P-витаминами. Мелатонин назначают в качестве нейропротектора при беременности, осложненной воспалением [31].
Предпринимаются попытки нейтрализовать повышенное содержание провоспалительных цитокинов внутривенным введением иммуноглобулина класса G (Ig G) человека [32]. Поликлональные IgG человека получают из плазмы большого количества здоровых доноров. Они достаточно безопасны и активно применяются в качестве иммуномодулирующих и противовоспалительных препаратов в акушерской практике при привычном невынашивании беременности [33]. IgG рекомендован также новорожденным с низкой массой тела для предотвращения развития инфекционных процессов.
В экспериментальных моделях на грызунах нами было показано, что IgG корригирует структурные и функциональные нарушения во всех звеньях репродуктивной оси [21, 22].
Механизмы противовоспалительного действия IgG до конца не раскрыты.
Предполагается, что константная часть молекулы Ig – Fc-фрагмент связывается с Fc-рецепторами на макрофагах, снижает их чувствительность к активации ЛПС через Toll-подобный рецептор и, следовательно, снижает экспрессию провоспалительных цитокинов. IgG могут также стимулировать дифференцировку противовоспалительных макрофагов [32].
В последние годы созданы принципиально новые противовоспалительные «генно-инженерные биологические препараты», применение которых позволило существенно повысить эффективность фармакотерапии. К ним относят моноклональные антитела к определенным детерминантам клеток иммунной системы или провоспалительным цитокинам и гибридные белковые молекулы, подавляющие активность цитокинов. Одним из таких препаратов является тоцилизумаб (ТЦЗ), созданный на основе рекомбинантных гуманизированных моноклональных антител к рецептору ИЛ-6 [10]. В настоящее время ТЦЗ применяется в терапии тяжёлой формы коронавирусной инфекции Covid-19 с цитокиновым штормом, связанным с недостаточным синтезом интерферона и выбросом провоспалительных цитокинов. ТЦЗ снижает смертность у пациентов с пневмонией и цитокиновым штормом [34]. В проводимых исследованиях не обнаружено значительных нарушений после его воздействия на плод. Согласно нашим данным, пренатальная блокада ИЛ-6-рецептора ТЦЗ вызывает снижение негативного влияния воспалительных процессов на развитие репродуктивной оси и половое созревание потомства у грызунов [22]. Однако использование этого препарата при беременности требует особой осторожности. Необходимым этапом является его апробирование на экспериментальных животных и дальнейшее наблюдение за рожденным потомством.
Для сохранения репродуктивного здоровья у мужчин и женщин мы акцентируем внимание на возможности коррекции последствий воздействия инфекционных факторов матери на ранних сроках беременности (первый триместр у человека). В пренатальном периоде необходимо нейтрализовать повышенное содержание провоспалительных цитокинов введением матери IgG либо антител к рецепторам этих цитокинов сразу после инфицирования. В неонатальном и раннем инфантильном периодах контролировать уровень половых гормонов в крови детей (рис. 2). Важно также налаживать информационный контроль педиатров об инфицировании матери в первом триместре беременности.
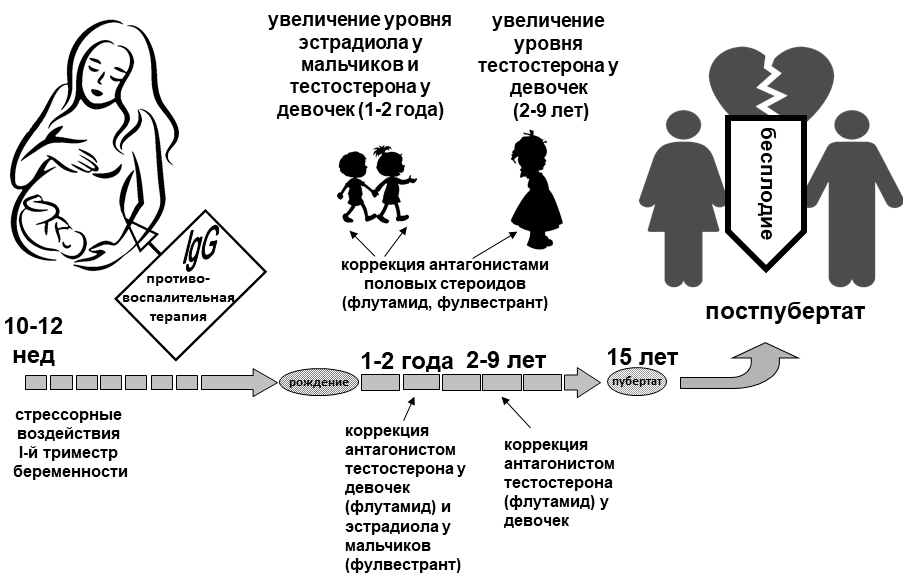
Рис. 2. Коррекция нарушений развития и функционирования репродуктивной системы, вызванных воспалением на ранних сроках беременности.
ЗАКЛЮЧЕНИЕ
Анализ литературных и собственных данных показал, что воздействия различных стрессорных стимулов в критические периоды развития нейроэндокринной системы и репродуктивной оси могут нарушать молекулярные механизмы регуляции развития и вызывать длительно текущие или необратимые изменения их функций. Появляется все больше доказательств, подтверждающих значимую роль нейровоспаления в патогенезе многих психоневрологических заболеваний. Для сохранения здоровья у потомства в последние годы внимание исследователей акцентируется на возможности коррекции нарушений развития плода уже в раннем онтогенезе.
1. Burdge G.C., Hanson M.A., Slater-Jefferies J.L. Epigenetic regulation of transcription: A mechanism for inducing variations in phenotype (fetal programming) by differences in nutrition during early life? Br. J. Nutr. 2007; 97:1036-1046. DOI:https://doi.org/10.1017/S0007114507682920.
2. Izvolskaia M.S., Sharova V.S., Zakharova L.A. Prenatal programming of neuroendocrine system development by Lipopolysaccharide: Long-term effects. Int. J. Mol. Sci. 2018; 19:-E3695. DOIhttps://doi.org/10.3390/ijms19113695.
3. Izvolskaia M.S., Sharova V.S., Zakharova L.A. Perinatal inflammation reprograms neuroendocrine, immune, and reproductive functions: Profile of cytokine biomarkers. Inflammation. 2020; 43:1175-1183. DOI:https://doi.org/10.1007/s10753-020-01220-1.
4. Zakharova L.A., Sharova V.S., Izvolskaia M.S. Mechanisms of reciprocal regulation of Gonadotropin-Releasing Hormone (GnRH)-producing and immune systems: The role of GnRH, cytokines and their receptors in early ontogenesis in normal and pathological conditions. Int. J. Mol. Sci. 2021; 22:114. https:// doi.org/10.3390/ijms22010114.
5. Izvolskaia M.S., Sharova V.S., Ignatiuk V.M., Voronova S.N., Zakharova L.A. Abolition of prenatal lipopolysaccharide-induced reproductive disorders in rat male offspring by fulvestrant. Andrologia. 2019; 51:-e13204. DOI: 10.1111/ and.13204.
6. Wang H.L., Pei D.E., Yang R.D., Wan C.L., Ye Y.M., Peng, S.S. Prenatal maternal vaginal inflammation increases anxiety and alters HPA axis signalling in adult male mice. Int. J. Dev. Neurosci. 2019; 75:27-35. DOI: 10.1016/ j.ijdevneu.2019.04.001.
7. Ardalan M., Chumak T., Vexler Z., Mallard C. Sex-dependent effects of perinatal inflammation on the brain: Implication for neuro-psychiatric disorders. Int. J. Mol. Sci. 2019;20:- pii: E2270. DOI:https://doi.org/10.3390/ijms20092270.
8. Saghazadeh A., Ataeinia B., Keynejad K., Abdolalizadeh A., Hirbod-Mobarakeh A., Rezaei N.A. Meta-analysis of pro-inflammatory cytokines in autism spectrum disorders: Effects of age, gender, and latitude. J. Psychiatr. Res. 2019; 115:90-102. DOI:https://doi.org/10.1016/j.jpsychires.2019.05.019.
9. Ignatiuk V.M., Izvolskaya M.S., Sharova V.S., Voronova S.N., Zakharova L.A. Disruptions in the reproductive system of female rats after prenatal lipopolysaccharide-induced immunological stress: role of sex steroids. Stress. 2019; 22: 33-141. DOI:https://doi.org/10.1080/10253890.2018.1508440.
10. Berardicurti O., Ruscitti P., Ursini F., D'Andrea S., Ciaffi J., Meliconi R. Mortality in tocilizumab-treated patients with COVID-19: a systematic review and meta-analysis. Clin. Exp. Rheumatol. 2020; 38:1247-1254.
11. Charmandari E., Achermann J.C., Carel J.C. Stress response and child health. Sci. Signal. 2012; 5:- mr1. DOI:https://doi.org/10.1126/scisignal.2003595.
12. Huang L.T. The link between perinatal glucocorticoids exposure and psychiatric disorders. Pediatr. Res. 2011; 69:19R-25R. DOIhttps://doi.org/10.1203/PDR. 0b013e318212c29b.
13. Langley-Evans S.C. Developmental programming of health and disease. Proc. Nutr. Soc. 2006; 65: 97-105. DOI:https://doi.org/10.1079/pns2005478.
14. Hazlett H.C., Poe M., Gerig G., Styner М., Chappell С., Smith R.G. Early brain overgrowth in autism associated with an increase in cortical surface area before age 2 years. Arch. Gen. Psychiatry. 2011; 68: 467-476. http://doi.10. 1001 /archgenpsychiatry.2011.39.
15. Zhou S.S., Zhou Y.M., Li D., Ma Q. Early Infant Exposure to Excess Multivitamin: A Risk Factor for Autism? Autism Res. Treat. 2013; 963697. http://doihttps://doi.org/10.1155/2013/963697.
16. Uciechowski P., Dempke W.C.M. Interleukin-6: A masterplayer in the cytokine network. Oncology. 2020; 98:131-137. DOI:https://doi.org/10.1159/000505099.
17. Clark L.F., Kodadek T. The Immune System and Neuroinflammation as Potential Sources of Blood-Based Biomarkers for Alzheimer's Disease, Parkinson's Disease, and Huntington's Disease. ACS Chem. Neurosci. 2016; 7: 520-527. DOI:https://doi.org/10.1021/acschemneuro.6b00042.
18. Wang S., Yan J.Y., Lo Y.K., Carvey P.M., Ling Z. Dopaminergic and serotoninergic deficiencies in young adult rats prenatally exposed to the bacterial lipopolysaccaharide. Brain Res. 2009; 1265: 196-204. DOI: 10.1016/ j.brainres.2009.02.022.
19. Vivekanantham S., Shah S., Dewji R., Dewji A., Khatri C., Ologunde R. Neuroinflammation in Parkinson's disease: role in neurodegeneration and tissue repair. Int. J. Neurosci. 2015; 125:717-725. DOIhttps://doi.org/10.3109/00207454.2014.982 795.
20. Sharova V.S., Izvolskaia M.S., Zakharova L.A. Lipopolysaccharide-induced maternal inflammation affects the gonadotropin-releasing hormone neuron development in fetal mice // Neuroimmunomodulation. 2015; 22:222-232. DOI:https://doi.org/10.1159/000365482.
21. Izvolskaia M.S., Ignatiuk V.M., Ismailova A.H., Sharova V.S., Zakharova L.A. IgG immune modulation in male mice with reproductive failure after prenatal inflammation // Reproduction. 2021; 161:669-679. DOI:https://doi.org/10.1530/REP-20-0386.
22. Ignatiuk V., Izvolskaia M., Sharova V., Zakharova L. Disruptions in Hypothalamic-Pituitary-Gonadal Axis Development and Their IgG Modulation after Prenatal Systemic Inflammation in Male Rats. Int. J. Mol. Sci. 2023;24: Issue 3:2726. DOI:https://doi.org/10.3390/ijms24032726.
23. Gholami M., Moosazadeh M., Haghshenash M.R., Jafarpour H., Mousavi T. Evaluation of the Presence of Bacterial and Viral Agents in the Semen of Infertile Men: A Systematic and Meta-Analysis Review Study. Front. Med. (Lausanne). 2022; 9: 835254. DOI:https://doi.org/10.3389/fmed.2022.835254.
24. Ginsberg Y., Khatib N., Weiner Z., Beloosesky R. Maternal Inflammation, Fetal Brain Implications and Suggested Neuroprotection: A Summary of 10 Years of Research in Animal Models. Rambam Maimonides Med. J. 2017;8: e0028. DOI:https://doi.org/10.5041/RMMJ.10305.
25. Labrousse V. F., Leyrolle Q., Amadieu C., Aubert A., Sere A., Coutureau E., Dietary omega-3 deficiency exacerbates inflammation and reveals spatial memory deficits in mice exposed to lipopolysaccharide during gestation. Brain Behav. Immun. 2018; 73:427-440. DOI:https://doi.org/10.1016/j.bbi.2018.06.004.
26. Maugeri A., Barchitta M., Blanco I., Agodi A. Effects of Vitamin D Supplementation During Pregnancy on Birth Size: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2019; 11:442. DOI:https://doi.org/10.3390/nu11020442.
27. Zhang Q., Chen H., Wang Y., Zhang C., Tang Z., Li H. Severe vitamin D deficiency in the first trimester is associated with placental inflammation in high-risk singleton pregnancy. Clin. Nutr. 2019; 38:1921-1926. DOI:https://doi.org/10.1016/j.clnu.2018.06.978.
28. Harlan De Crescenzo A., Panoutsopoulos A. A., Tat L., Schaaf Z., Racherla S., Henderson L. Deficient or Excess Folic Acid Supply During Pregnancy Alter Cortical Neurodevelopment in Mouse Offspring. Cereb. Cortex. 2021; 31:635-649. DOI:https://doi.org/10.1093/cercor/bhaa248.
29. Chen S. R., Liu Y. X. Testis Cord Maintenance in Mouse Embryos: Genes and Signaling. Biol. Reprod. 2016; 94:42. DOI:https://doi.org/10.1095/biolreprod.115.137117.
30. Parker-Athill E., Luo D., Bailey A., Giunta B., Tian J., Shytle R. D. Flavonoids, a prenatal prophylaxis via targeting JAK2/STAT3 signaling to oppose IL-6/MIA associated autism. J. Neuroimmunol. 2009; 217:20-27. DOI:https://doi.org/10.1016/j.jneuroim.2009.08.012.
31. Wilkinson D., Shepherd E., Wallace E. M. Melatonin for women in pregnancy for neuroprotection of the fetus. Cochrane Database Syst.Rev. 2016; 3: CD010527. DOI:https://doi.org/10.1002/14651858.CD010527.
32. Domínguez-Soto Á., Simón-Fuentes M., de Las Casas-Engel M., Cuevas V.D., López-Bravo M., Domínguez-Andrés J. IVIg promote cross-tolerance against inflammatory stimuli in vitro and in vivo. J. Immunol. 2018;201:41-52. DOI:https://doi.org/10.4049/jimmunol.1701093.
33. Han A.R., Lee S.K. Immune modulation of i.v. immunoglobulin in women with reproductive failure. Reprod. Med. Biol. 2018; 17:115-124. DOI:https://doi.org/10.1002/rmb2.12078.
34. Kim J.S., Lee J.Y., Yang J.W., Lee K.H., Effenberger M., Szpirt W. Immunopathogenesis and treatment of cytokine storm in COVID-19. Theranostics. 2021; V. 11:316-329. DOI:https://doi.org/10.7150/t








